Penulis: Azizul Berlyansah., S.Si., M.Biomed., AIFO.
Selama ini, sel lemak atau adiposit sering dipandang sebagai gudang energi pasif atau sekadar tempat menumpuk kelebihan kalori dari makanan. Namun, penelitian terkini menunjukkan bahwa sel lemak ternyata jauh lebih kompleks dari yang kita bayangkan. Ia bukan hanya penyimpan energi, tetapi juga “penyimpan kenangan” biologis tubuh. Fenomena ini dikenal sebagai memori sel lemak (lipid cell memory), yaitu kemampuan sel adiposa untuk mengingat kondisi metabolik sebelumnya dan memengaruhi respons tubuh di masa mendatang (1,2).
Gambar 1. Sel lemak di bawah mikroskop elektron (2).
1. Ketika Lemak Belajar dari Masa Lalu
Peneliti terbaru terkait metabolisme menemukan bahwa sel lemak dapat “mengingat” pengalaman nutrisi, stres, dan peradangan yang pernah dialami tubuh. Misalnya, ketika seseorang mengalami kelebihan kalori untuk waktu lama, gen dalam sel lemak mengalami perubahan epigenetik seperti metilasi DNA dan modifikasi histon yang mengubah cara gen tersebut diekspresikan. Akibatnya, walaupun berat badan sudah kembali normal setelah diet, sebagian sel lemak tetap mempertahankan “memori obesitas”-nya. Inilah yang menyebabkan banyak orang sulit menjaga berat badan ideal setelah menurunkannya (3,4). Sebuah studi menemukan bahwa sel lemak pada tikus yang pernah mengalami obesitas menunjukkan aktivitas gen pro-inflamasi yang bertahan bahkan setelah penurunan berat badan. Ini menunjukkan bahwa adipocyte memory bukan sekadar fenomena sementara, melainkan bentuk “jejak metabolik” yang memengaruhi keseimbangan energi jangka Panjang (4–6).
2. Epigenetik: Buku Catatan Sel Lemak
Konsep memori sel lemak erat kaitannya dengan ilmu epigenetika bidang yang mempelajari bagaimana faktor lingkungan dapat mengubah ekspresi gen tanpa mengubah urutan DNA itu sendiri. Setiap paparan makanan tinggi lemak, stres oksidatif, atau peradangan dapat meninggalkan tanda kimia pada DNA sel lemak. Tanda-tanda ini berfungsi layaknya “catatan” yang memberi tahu sel bagaimana harus berperilaku di masa depan (7). Contohnya, penelitian menunjukkan bahwa diet tinggi gula dapat menyebabkan metilasi berlebihan pada gen yang mengatur pembakaran lemak, sehingga menghambat proses lipolisis bahkan setelah pola makan kembali normal. Dengan kata lain, tubuh “mengingat” pola makan buruk sebelumnya dan menyesuaikan metabolisme berdasarkan kenangan tersebut (8,9).
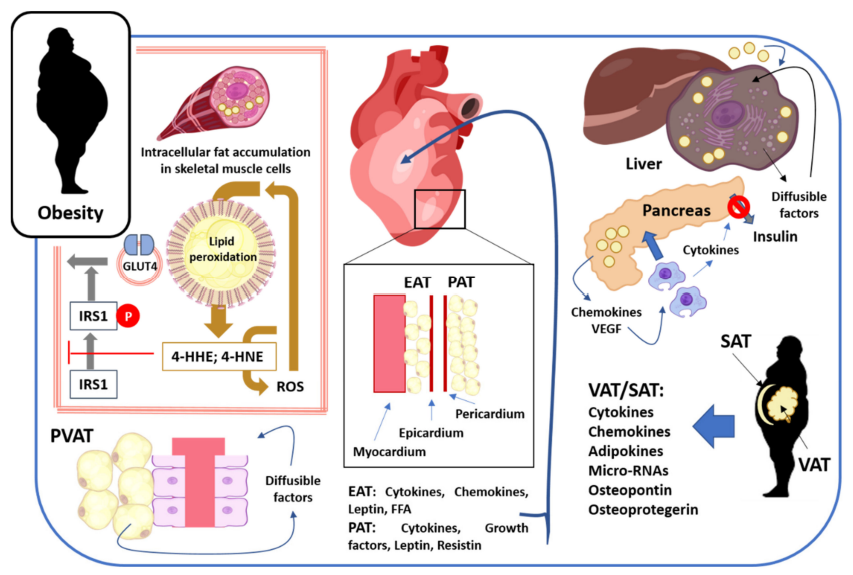
Gambar 2. Dampak jaringan adiposa pada individu obesitas. Pada otot rangka, lemak menumpuk di dalam serat otot dan mengganggu metabolisme sel, memicu peroksidasi lipid. Proses ini menghasilkan mediator seperti 4-HNE yang menghambat fosforilasi IRS1 dan mengganggu transpor GLUT4, yang seharusnya diaktifkan oleh insulin. Akibatnya, timbul resistensi insulin. Jaringan adiposa di sekitar pembuluh darah (PVAT) mengeluarkan berbagai faktor yang memengaruhi fungsi pembuluh darah dan peradangan. Lemak juga menumpuk di jantung (EAT dan PAT) dan menghasilkan molekul yang mengganggu fungsi jantung. Di hati, penumpukan lemak di dalam sel menyebabkan resistensi insulin, peningkatan lipogenesis, dan perubahan fungsi hati. Di pankreas, lemak menumpuk di luar sel dan mengeluarkan molekul yang menarik makrofag, yang kemudian menghambat sekresi insulin. Selain itu, lemak subkutan (SAT) dan viseral (VAT) juga menumpuk, terutama di perut, dan melepaskan banyak molekul yang memengaruhi berbagai organ dan jaringan tubuh. Secara keseluruhan, terdapat interaksi dua arah (crosstalk) antara jaringan adiposa dan organ lain melalui zat-zat yang menyebar secara lokal maupun sistemik (10).
3. Lipid Cell Memory dan Penyakit Metabolik
Fenomena memori pada sel lemak memiliki dampak besar terhadap berbagai penyakit metabolik seperti diabetes tipe 2, obesitas, dan sindrom metabolik. Ketika sel lemak menyimpan “memori inflamasi” dari masa lalu, ia menjadi lebih mudah mengaktifkan jalur peradangan seperti NF-κB dan TNF-α. Akibatnya, resistensi insulin lebih mudah terjadi, bahkan tanpa kelebihan berat badan yang nyata. Selain itu, sel lemak di berbagai lokasi tubuh seperti lemak subkutan dan viseral memiliki karakteristik memori yang berbeda. Lemak viseral (di sekitar organ dalam) lebih mudah mengingat stres metabolik, Hal ini membuatnya lebih rentan terhadap stres tersebut dan berdampak negatif dalam jangka panjang (11,12).
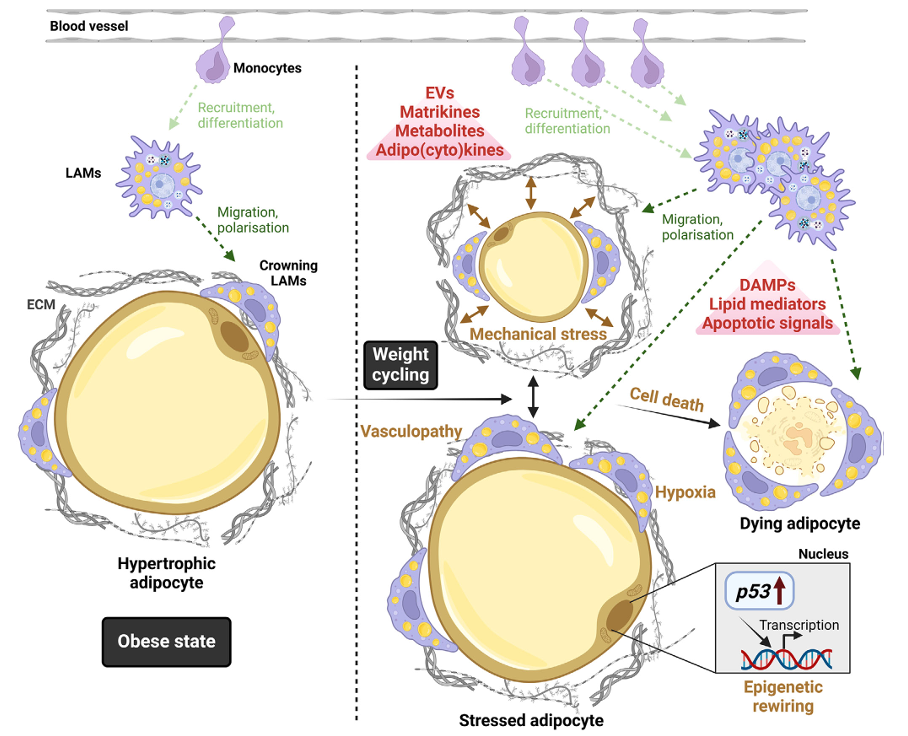
Gambar 3. Gambar ini menunjukkan bagaimana siklus berat badan (naik-turun berat badan) menyebabkan stres pada sel lemak (adiposit) yang membesar dan menyusut, memicu stres metabolik, hipoksia, dan bahkan kematian sel. Sel-sel yang stres ini melepaskan sinyal seperti DAMPs, vesikel ekstraseluler, dan sitokin, yang merekrut monosit dari pembuluh darah. Monosit ini kemudian berdiferensiasi menjadi makrofag LAM (Lipid-Associated Macrophages) dan mengalami polarisasi sesuai kondisi sekitar. Proses ini dapat memperburuk peradangan jaringan adiposa dan mengganggu fungsi metabolik tubuh (13).
4. Bisakah Memori Lemak Dihapus?
Pertanyaan menarik yang kini dikaji para ilmuwan adalah: apakah memori sel lemak bisa dihapus? Beberapa penelitian menunjukkan bahwa olahraga intens, pola makan sehat tinggi antioksidan, serta paparan suhu dingin (cold exposure) dapat mengubah kembali ekspresi gen pada sel lemak, terutama dengan mengaktifkan jenis lemak “baik” yang disebut brown adipose tissue (BAT). Lemak jenis ini membantu membakar energi dan memperbaiki sensitivitas insulin (4,14). Intervensi epigenetik dengan senyawa alami seperti resveratrol dan kurkumin juga tengah diteliti karena kemampuannya memodifikasi tanda epigenetik pada DNA, yang berpotensi “menghapus” sebagian memori negatif sel lemak (15).
5. Menatap Masa Depan: Lemak Sebagai Arsip Metabolik
Penemuan bahwa lipid cell memiliki memori mengubah cara kita memandang jaringan adiposa. Ia bukan sekadar timbunan lemak, tetapi arsip biologis yang merekam sejarah metabolisme tubuh kita. Setiap kebiasaan makan, gaya hidup, dan paparan lingkungan meninggalkan jejak molekuler yang menentukan bagaimana tubuh merespons di masa depan. Pemahaman ini membuka peluang baru dalam terapi penyakit metabolik, bukan hanya dengan menurunkan berat badan, tetapi juga dengan “menghapus” atau “menulis ulang” memori sel lemak itu sendiri. Mungkin, di masa depan, menjaga kesehatan tidak lagi sebatas menghitung kalori, tetapi juga menjaga agar sel lemak kita tidak menyimpan kenangan yang salah (13).
Editor: Ambarwulan, S.T.
Referensi:
1. Han S ji, Zaretsky AG, Andrade-oliveira V, Collins N, Dzutsev A, Shaik J, et al. The white adipose tissue is a reservoir for memory T cells that promotes protective memory responses to infection. Immunity. 2018;47(6):1154–68.
2. Watson T. Fat cells have a ‘memory’ of obesity after weight loss. Nature. 2024;
3. Zhang Y, Mei H, Chang X, Chen F, Zhu Y, Han X. Adipocyte-derived microvesicles from obese mice induce M 1 macrophage phenotype through secreted miR- 155. 2016;8:505–17.
4. Reinisch I, Michenthaler H, Sulaj A, Moyschewitz E, Krstic J, Galhuber M, et al. Adipocyte p53 coordinates the response to intermittent fasting by regulating adipose tissue immune cell landscape. 2024;1–21.
5. Loos RJF, Yeo GSH. The genetics of obesity : from discovery to biology. 2022;23(February).
6. Cottam MA, Caslin HL, Winn NC, Hasty AH. Multiomics reveals persistence of obesity-associated immune cell phenotypes in adipose tissue during weight loss and weight regain in mice. Nat Commun. 2022;(2022):1–16.
7. Balcerczyk A, Szemraj J. Chronic and Transient Hyperglycemia Induces Changes in the Expression Patterns of IL6 and ADIPOQ Genes and Their Associated Epigenetic Modifications in Differentiating Human Visceral Adipocytes. 2021;1–19.
8. Kageyama I, Yamada H, Munetsuna E, Yamazaki M, Sakakibara T, Teshigawara A, et al. Differential effects of excess high-fructose corn syrup on the DNA methylation of hippocampal neurotrophic factor in childhood and adolescence. PLoS One [Internet]. 2022;1–13. Available from: http://dx.doi.org/10.1371/journal.pone.0270144
9. Methylation HD cpg, Wang Y, Chen L, William M, Phillip B, Methylation D cpg. iScience ll High Glucose Induces Lipid Accumulation via 25-. ISCIENCE [Internet]. 2020;23(5):101102. Available from: https://doi.org/10.1016/j.isci.2020.101102
10. Verd E, Homs J, Boadas-vaello P. Physiological Changes and Pathological Pain Associated with Sedentary Lifestyle-Induced Body Systems Fat Accumulation and Their Modulation by Physical Exercise. 2021;
11. Ahmed B, Si H. The Aging of Adipocytes Increases Expression of Pro-Inflammatory Cytokines Chronologically. 2021;
12. Lindhorst A, Gericke M, Raulien N, Wieghofer P, Eilers J, Rossi FM V. Adipocyte death triggers a pro-in fl ammatory response and induces metabolic activation of resident macrophages. Cell Death Dis [Internet]. 2021; Available from: http://dx.doi.org/10.1038/s41419-021-03872-9
13. Reinisch I, Enzenhofer S. Mechanisms of Lipid-Associated Macrophage Accrual in Metabolically Stressed Adipose Tissue. 2025;1–11.
14. Scheel AK, Espelage L, Chadt A. Many Ways to Rome : Exercise , Cold Exposure and Diet — Do They All Affect BAT Activation and WAT Browning in the Same Manner ? 2022;
15. Hosseini H, Teimouri M, Shabani M, Koushki M, Khorzoughi RB, Namvarjah F, et al. Resveratrol alleviates non-alcoholic fatty liver disease through epigenetic modification of the Nrf2 signaling pathway. Int J Biochem Cell Biol [Internet]. 2019;105667. Available from: https://doi.org/10.1016/j.biocel.2019.105667